杜克大学(Duke University, Durham)领导的研究发现,RNA发夹导致上游启动密码子(uAUGs)的高翻译,从而导致mRNA翻译中的情境依赖性交通堵塞。
在一篇发表在《自然》杂志上的论文《无处不在的下游RNA发夹动态地决定了开始密码子的选择》中,研究小组描述了他们在拟南芥中发现的一种翻译调节机制,以及随后在人类中发现的类似机制。同一期刊上的一篇新闻与观点文章讨论了该团队所做的工作。
任何基因组都是由指示何时开始和停止RNA片段转录的指令构成的。这些片段可以包含多个起始密码子,然后这些密码子可以选择性地用作核糖体开始将它们翻译成蛋白质的起点。目前的研究已经确定了一种机制,通过这种机制,在潜在的起点之间进行选择过程。
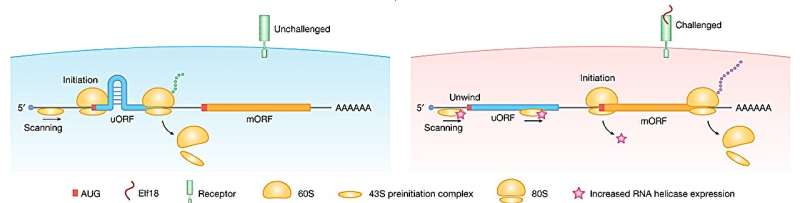
核糖体亚基组装在mRNA分子上并扫描其寻找AUG启动密码子以启动蛋白质合成。有时,遇到的第一个起始密码子被用作起始密码子,有时,它不被识别。如果未被识别,则继续向下扫描mRNA,在那里它可能会找到另一个起点或更容易识别的起点(主AUG)。
研究发现,如果mRNA在两个起始密码子之间有一个发夹环,则扫描过程会减慢,从而为上游起始密码子(uAUG)的识别提供了更多的时间,从而导致从该起始点开始的翻译率更高。
在elf18(一种细菌蛋白片段)引发的免疫反应下,研究拟南芥幼苗,以确定密码子选择的变化。研究发现,在elf18的作用下,上游起始密码子的核糖体活性降低,这表明在这些条件下,翻译优先从更容易识别的起始点(主AUG)开始。
该研究确定了RNA解旋酶,特别是rh37样解旋酶,在拟南芥免疫应答过程中参与解开靠近uAUGs的发夹结构。在免疫反应下,这些解旋酶水平的升高消除了由发夹引起的交通堵塞,从而增加了替代起始密码子的翻译,从而产生了不同的蛋白质。
这种“如果这样,那么那样”的机制很像逻辑门,允许相同的mRNA片段在情况要求时产生另一种蛋白质。
研究人员在ATF4的起始密码子下游引入了一个发夹结构,ATF4是一种众所周知的哺乳动物应激反应基因,在细胞应激条件下表达水平较高。这种情况通过增强一个不太被识别的起始密码子的翻译起始来抑制ATF4的翻译。
研究人员对与乳腺癌相关的BRCA1 mRNA的突变版本进行了体内分析。已知突变体BRCA1 mRNA通过具有多个起始密码子来调节。该分析使用SHAPE-MaP分析检测到uAUG2和uAUG3下游的活性显著降低,表明在哺乳动物转录本中存在发夹结构。
实验结果表明,上游启动密码子和下游发夹结构介导的翻译起始机制不仅限于植物,也存在于人类细胞中并发挥作用。这表明,在不同生物体中,翻译起始的密码子选择存在普遍的逻辑门机制,具有保守的进化见解和未来的治疗靶向意义。
©2023 Science X Network
本文来自作者[admin]投稿,不代表kvoge号立场,如若转载,请注明出处:https://m.kvoge.cn/zlan/202508-3716.html


评论列表(4条)
我是kvoge号的签约作者“admin”!
希望本篇文章《下游RNA发夹在调控mRNA翻译中的新角色》能对你有所帮助!
本站[kvoge号]内容主要涵盖:国足,欧洲杯,世界杯,篮球,欧冠,亚冠,英超,足球,综合体育
本文概览:...